حبة حلب اللايشمانيا الجلدية
داء الليشمانيات الجلدي:
داء الليشمانيات الجلدي عدوى طفيلية واسعة الانتشار تسببها طفيليات الليشمانيا التي تحملها إناث ذباب الرمل. تتراوح أعراضه بين تقرحات بسيطة ومرض جهازي مميت، أي ظهور آفات جلدية منتشرة على نطاق واسع بأنواع مختلفة. يُعرّض هذا المرض ما يقرب من 350 مليون شخص للخطر، وهو متوطن في أكثر من 98 دولة. يبلغ عدد الحالات المسجلة عالميًا 12 مليون حالة، مع تسجيل ما بين 2 و2.5 مليون حالة جديدة سنويًا. تُصنّف منظمة الصحة العالمية داء الليشمانيات الجلدي ضمن الأمراض المهملة بشدة. في السابق، كان من الصعب تحديد الطفيلي المسبب للعدوى، لكن تقنيات الحمض النووي الحديثة سهّلت تحديد نوع الليشمانيا، مما يسمح باتخاذ قرارات علاجية سريعة. أصبح التحديد السريع لليشمانيا ممكنًا باستخدام تقنية تفاعل البوليميراز المتسلسل (PCR). لا يوجد حاليًا لقاح للوقاية من داء الليشمانيات، وغالبًا ما يكون العلاج الدوائي غير فعال. هناك حاجة ماسة لإجراء دراسات واسعة النطاق ودقيقة للمساعدة في مكافحته. يُعدّ الأمفوتريسين ب، وإيزيثيونات البنتاميدين، والباروموميسين، ومضادات الفطريات من بين الأدوية الموصى بها للعلاج. ومن خلال تنظيم دورات تدريبية مباشرة وشخصية، والتي تُعتبر خطوة حاسمة في تحسين المواقف والإجراءات الوقائية تجاه داء الليشمانيات الجلدي ومكافحته في المناطق الموبوءة، من الضروري التأكيد على أهمية وضرورة تثقيف هذه الفئة المعرضة للخطر.
1. مقدمة:
لا يزال داء الليشمانيات، وهو مرض معدٍ تسببه طفيليات من جنس الليشمانيا، يمثل مشكلة صحية عامة خطيرة في 190 دولة نامية [ 1 ]. ويمكن أن تؤدي الإصابة بطفيلي الليشمانيا إلى أحد الأشكال السريرية الثلاثة الرئيسية، وذلك بحسب نوع الطفيلي المسبب للعدوى.الليشمانيا الرضيعيةوL. chagasiوقد تبين أنها متطابقة عن طريق التنميط الجيني [ 2 ]الليشمانيا الشاغاسيةتعتبر فئة فرعية من السكانالليشمانيا الرضيعيةنشأت هذه السلالات من سلالات أوروبية مستوردة [ 3 ، 4 ، 5 ]، ولذلك ينبغي اعتبارها مترادفات، وهي موجودة في كل من شمال غرب الولايات المتحدة وغربها. النوع الأول هو داء الليشمانيات الجلدي الموضعي، والذي قد يُسبب قرحة جلدية واحدة أو عدة قرح، بالإضافة إلى آفات ثانوية أو التهاب الأوعية اللمفاوية العقدي. أما النوع الثالث فهو داء الليشمانيات الجلدي المصحوب بإصابة الأغشية المخاطية، وهو داء الليشمانيات الحشوي الجهازي، الذي يُصيب الأعضاء الداخلية مثل الكبد والطحال ونخاع العظم، ويكون مميتًا إذا لم يُعالج. أما النوع الثاني فهو داء الليشمانيات الجلدي غير المصحوب بإصابة الأغشية المخاطية [ 6 ].
الذكور أكثر عرضة للإصابة بهذا المرض من الإناث [ 7 ]. ينتشر داء الليشمانيات عن طريق ذباب الرمل، من جنس فليبوتوموس في العالم القديم وجنس لوتزوميا في العالم الجديد. ينتمي ناقل هذا المرض إلى رتبة ذوات الجناحين، فئة الحشرات، عائلة ذباب الرمل [ 8 ]. يبلغ طول ذبابة الرمل 3 مم، وتُعرف بطيرانها القافز. تتميز بأرجل طويلة وهشة، وأجزاء فم تشبه الخنجر، وعيون داكنة كبيرة، وقرون استشعار طويلة، وأجزاء فم متجهة للأسفل [ 9 ].
تنتقل عدوى الليشمانيا عن طريق لدغات إناث ذباب الرمل، حيث تُسبب 20 نوعًا مختلفًا من هذه الطفيليات المرض. وينتشر المرض عن طريق 30 نوعًا مختلفًا من ذباب الرمل. ويُعتبر الإنسان والحيوانات الأليفة أو غير البرية مضيفًا خازنًا لهذه الطفيليات. تتغذى إناث ذباب الرمل على المضيف الخازن فتُصاب بالمرض [ 10 ]. كما ينتشر هذا الطفيلي عن طريق استخدام الحقن الملوثة من المرضى.الليشمانيا الشاغاسي، الليشمانيا الطفلية،والليشمانيا الدونوفانيةتُعدّ الأنواع الشائعة [ 11 ]. ونظرًا لهجرة الأفراد نحو المناطق الحضرية خلال العشرين عامًا الماضية، فقد لوحظ ازدياد محتمل في حالات داء الليشمانيات [ 12 ]. وينتشر داء الليشمانيات بين الأشخاص الذين يعيشون في مناطق غير موبوءة عن طريق السفر.
سبع دول فقط – الجزائر، وأفغانستان، والبرازيل، وإيران، وبيرو، وسوريا، والمملكة العربية السعودية – تمثل 90% من جميع حالات داء الليشمانيات الجلدي. يُعد داء الليشمانيات الجلدي أكثر أنواع الليشمانيا السريرية شيوعًا في العالم [ 13 ]. وتنتشر أنواع الليشمانيا الطفيلية في العالم القديم، مثل…الليشمانيا الرضيعية،L. tropicaوL. major(شائعة في الشرق الأوسط، والقرن الأفريقي، وحوض البحر الأبيض المتوسط، وشبه القارة الهندية)، وأنواع العالم الجديد، مثلL. chagasi،L. mexicana،L. amazonensis، L. naiffi(مستوطن في أمريكا الوسطى والجنوبية). غالبًا ما تسبب أنواع العالم القديم قرحًا محدودة ذاتيًا، ولكن داء الليشمانيات الجلدي الأمريكي، الذي يسبب أيضًا داء الليشمانيات الجلدي المنتشر (MCL) وداء الليشمانيات الجلدي المنتشر (DCL)، عادة ما تسببه أنواع العالم الجديد [ 14 ].
يُظهر مرضى داء الليشمانيات طيفًا واسعًا من الاستجابة المناعية، بدءًا من أولئك الذين يتمتعون باستجابة قوية للخلايا التائية، كما يتضح من فرط الحساسية المتأخر (DTH) وارتفاع مستويات الإنترفيرون غاما (IFNγ)، وصولًا إلى أولئك الذين يفتقرون إلى استجابة فرط الحساسية المتأخر ولكن لا تزال لديهم مستويات عالية من الأجسام المضادة [ 11 ]. ويُلاحظ لدى البعض الآخر ممن لديهم فرط حساسية متأخر قوي وجود عدد قليل من الطفيليات في آفاتهم لأن الليشمانيا تُقتل بواسطة البلاعم المُنشطة بالإنترفيرون غاما بدلًا من تحييدها بواسطة الأجسام المضادة، بينما يعجز الأشخاص الذين لديهم استجابة مناعية خلطية فقط عن السيطرة على عدد الطفيليات [ 15 ، 16 ].
إضافةً إلى اختلاف الأعراض السريرية باختلاف أنواع الليشمانيا، فإنها تختلف أيضًا في استجابتها للعلاجات [ 17 ]. ولذلك، يُعدّ تحديد النوع أمرًا بالغ الأهمية لكيفية ظهور داء الليشمانيات سريريًا. كان تحديد طفيل الليشمانيا المُسبّب للمرض صعبًا في السابق، على عكس العديد من الأمراض المعدية الأخرى. ومع تطور تقنيات الحمض النووي الحديثة، أصبح من السهل الآن التعرّف على طفيليات الليشمانيا. وانطلاقًا من شعار “لدغة صغيرة، خطر كبير”، سلّطت منظمة الصحة العالمية الضوء على الخطر المتزايد للأمراض المنقولة بالنواقل، ولا سيما داء الليشمانيات، في اليوم العالمي للصحة عام 2014 [ 18 ]. ولتحسين إدارة النواقل، والتشخيص، وأدوات العلاج للوقاية من المزيد من الإصابات والمراضة، يُصنّف داء الليشمانيات ضمن الفئة الأولى من الأمراض الناشئة وغير المُسيطَر عليها، ويتطلّب دراسةً مُعمّقة. تتناول هذه المراجعة بشكل أساسي تشخيص داء الليشمانيات الجلدي، وإدارته، والوقاية منه، واستراتيجيات إدارته ومكافحته، سواءً تلك الناجمة عن أنواع الليشمانيا من العالم القديم أو العالم الجديد.
خلاصة:
داء الليشمانيات الجلدي عدوى طفيلية واسعة الانتشار تسببها طفيليات الليشمانيا التي تحملها إناث ذباب الرمل. تتراوح أعراضه بين تقرحات بسيطة ومرض جهازي مميت، أي ظهور آفات جلدية منتشرة على نطاق واسع بأنواع مختلفة. يُعرّض هذا المرض ما يقرب من 350 مليون شخص للخطر، وهو متوطن في أكثر من 98 دولة. يبلغ عدد الحالات المسجلة عالميًا 12 مليون حالة، مع تسجيل ما بين 2 و2.5 مليون حالة جديدة سنويًا. تُصنّف منظمة الصحة العالمية داء الليشمانيات الجلدي ضمن الأمراض المهملة بشدة. في السابق، كان من الصعب تحديد الطفيلي المسبب للعدوى، لكن تقنيات الحمض النووي الحديثة سهّلت تحديد نوع الليشمانيا، مما يسمح باتخاذ قرارات علاجية سريعة. أصبح التحديد السريع لليشمانيا ممكنًا باستخدام تقنية تفاعل البوليميراز المتسلسل (PCR). لا يوجد حاليًا لقاح للوقاية من داء الليشمانيات، وغالبًا ما يكون العلاج الدوائي غير فعال. هناك حاجة ماسة لإجراء دراسات واسعة النطاق ودقيقة للمساعدة في مكافحته. يُعدّ الأمفوتريسين ب، وإيزيثيونات البنتاميدين، والباروموميسين، ومضادات الفطريات من بين الأدوية الموصى بها للعلاج. ومن خلال تنظيم دورات تدريبية مباشرة وشخصية، والتي تُعتبر خطوة حاسمة في تحسين المواقف والإجراءات الوقائية تجاه داء الليشمانيات الجلدي ومكافحته في المناطق الموبوءة، من الضروري التأكيد على أهمية وضرورة تثقيف هذه الفئة المعرضة للخطر.
الكلمات المفتاحية
- داء الليشمانيات الجلدي
- الأوليات
- تشخبص
- تفاعل البوليميراز المتسلسل (PCR)
- تعريف
2. دورة حياة ذبابة الرمل والليشمانيا:
في وجبة الدم التي تتلقاها العديد من المفصليات الماصة للدماء، تتحول الأمستيجوتات (خلايا أولية غير متحركة) التي تم التهامها في العائل المصاب إلى بروماستيغوتات (ذات سوط خارجي). وعندما يكون العائل غير مناسب، تُطرح الطفيليات مع البراز [ 19 ]. عند هضم وجبة الدم، ترتبط التريبانوسومات، مثل أنواع الليشمانيا وغيرها، بالطفيليات الموجودة على ظهارة الأمعاء الوسطى. يبقى الطفيل بعد ذلك في الأمعاء ويبدأ مرحلة تمايز [ 20 ]. ثم تنتقل البروماستيغوتات إلى الأمعاء الأمامية لذبابة الرمل، المغطاة بالكيوتيكل. في الأمعاء الأمامية، يلتصق بعضها ويبقى البعض الآخر حرًا لينتقل لاحقًا عن طريق اللدغة [ 21 ] إلى العائل الفقاري.
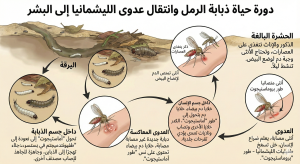
تتكاثر الطفيليات الأولية (البروماستيجوت) عن طريق الاندماج الثنائي في الجهاز الهضمي لذبابة الرمل. بعد سبعة أيام، تخضع هذه الطفيليات لعملية التحول إلى طور معدي (البروماستيجوتات الميتاسيكلية). تقوم ذبابة الرمل بثقب جلد العائل أثناء التغذية لحقن اللعاب والبروماستيجوتات الميتاسيكلية فيه .
تتحول هذه الطفيليات إلى شكل الأمستيجوت داخل البلاعم المضيفة. وتتكاثر داخل الفاجوليسوسوم عن طريق الانشطار الثنائي حتى تنفجر الخلية وتنشر العدوى إلى خلايا بلعمية أخرى. وهذا ما يُبقي الدورة مستمرة.
3. الدفاع المبكر ضد الليشمانيا:
تتميز أنواع الليشمانيا المتعددة المسببة لداء الليشمانيات الجلدي بخصائص فريدة. ومع ذلك، تشترك هذه الطفيليات في دورة حياة واحدة، حيث تنقل ذبابة الرمل الطور السوطي (البروماستيجوت)، وهو شكل سوطي من الطفيل، إلى عوائل ثديية مثل الإنسان والكلاب والقوارض [ 22 ]. تدخل الطور السوطي خلايا بلعمية مختلفة بعد دخولها الجلد عن طريق لدغة ذبابة الرمل. يتحول الطور السوطي إلى الطور اللا سوطي (الأماستيجوت)، وهو شكل دائري غير سوطي قادر على التكاثر، داخل الجسيم البلعمي للخلايا البلعمية الكبيرة. عندما تتغذى ذبابة الرمل على العائل، يتحول الطور اللا سوطي إلى طور سوطي ويتكاثر داخلها، وبذلك تكتمل دورة الحياة. مع ذلك، خلال العدوى الطبيعية، تنتقل عناصر أخرى موجودة في لعاب ذبابة الرمل إلى الجلد، مما يؤثر على الاستجابات المناعية المبكرة. تتضمن معظم العدوى التجريبية حقن الطور السوطي في الجلد بإبرة [ 23 ]. لذلك يجب تفسير الأهمية البيولوجية للدراسات التي تبحث في الاستجابة المبكرة للعدوى دون مراعاة الظروف الموجودة أثناء العدوى الطبيعية، مثل موقع التلقيح وعدد الطفيليات والمكونات الموجودة أثناء لدغة ذبابة الرمل، بعناية [ 24 ، 25 ].
في حين أن الخلايا المتعادلة والخلايا المتغصنة والخلايا الوحيدة التي يتم تجنيدها إلى موقع العدوى لديها أيضًا فرصة للإصابة بالطفيلي وتلعب أدوارًا حاسمة ومميزة في إنشاء الاستجابة المناعية للعدوى.
4. أسباب داء الليشمانيات:
يُعدّ داء الليشمانيات الجلدي أكثر أنواع الليشمانيات شيوعاً بين البشر. وهو مرض جلدي ينتقل عن طريق لدغة ذبابة الرمل، ويسببه طفيلي وحيد الخلية. ويبلغ عدد أنواع الليشمانيا التي تُسبب داء الليشمانيات الجلدي حوالي ثلاثين نوعاً.
5. العلامات والأعراض (التشخيص)
5.1 داء الليشمانيات الجلدي
تُستخدم عادةً عينات كشط الجلد – التي تُجمع غالبًا من الآفات الجلدية – والتي تُفحص مجهريًا لتشخيص داء الليشمانيا. ورغم سرعة هذه الطريقة وانخفاض تكلفتها، إلا أنها ذات حساسية منخفضة، خاصةً في الآفات المزمنة [ 26 ]. كما أن البكتيريا والفطريات الموجودة في عينات الخزعة قد تُلوث مزارع الآفات. بالإضافة إلى ذلك، تختلف متطلبات النمو بين الأنواع. يُمكن استخدام الرحلان الكهربائي للإنزيمات المتماثلة لتحديد أنواع الليشمانيا، إلا أن هذه العملية تستغرق وقتًا طويلاً ومكلفة وتتطلب زراعة مكثفة للطفيلي. وعلى الرغم من أن تفاعل البوليميراز المتسلسل (PCR) هو الأفضل للفحص المباشر للعينات السريرية، إلا أنه يُمكن أيضًا استخدام الأجسام المضادة وحيدة النسيلة لتحديد الأنواع في السلالات المزروعة. يتميز تفاعل البوليميراز المتسلسل (PCR) بحساسية ونوعية عاليتين وسرعة في الكشف عن الليشمانيا وتوصيفها الجيني في الوقت نفسه [ 27 ]. وقد بلغت حساسية تفاعل البوليميراز المتسلسل (PCR) في إحدى الدراسات على داء الليشمانيا الجلدي الأمريكي 100% [ 28 ]. نظراً لعدم وجود توليد كبير للأجسام المضادة في داء الليشمانيات الجلدي، فإن الكشف عن الأجسام المضادة ليس حساساً للغاية.
بالإضافة إلى ذلك، في حالات داء الليشمانيات الجلدي الأمريكي، وردت تقارير عن تفاعل متقاطع بين مستضدات الليشمانيا والأجسام المضادة التي تنتجها أنواع أخرى من الكينيتوبلاستيدات، مثلالتريبانوسوما كروزيتم إجراء [ 29 ]. اختبار مونتينيغرو (الليشمانين) الجلدي، الذي يبحث عن نوع معين من فرط الحساسية المتأخرة على الجلد، هو طريقة أخرى لتشخيص داء الليشمانيات الجلدي متاحة حاليًا.إل مكسيكانايُحقن المستضد داخل الأدمة مع مراقبة رد الفعل الطبيعي [ 30 ]. تشمل قيود هذا الاختبار صعوبة التمييز بين العدوى الموجودة حاليًا والعدوى التي حدثت بالفعل، بالإضافة إلى حالات النتائج الإيجابية الكاذبة في حالات الأمراض الجلدية الأخرى [ 31 ].
5.2 داء الليشمانيات المخاطي الجلدي:
تتطور الليشمانيا المخاطية الجلدية بعد بدء الليشمانيا الجلدية، وتتميز بتدمير القنوات البلعومية والفموية والأنفية. كما تتأثر الإصابة بهذا المرض بشكل كبير بالعوامل الوراثية. على الرغم من أن التهاب الأنف واحتقانه هما العلامتان المبكرتان الرئيسيتان لليشمانيا المخاطية الجلدية، إلا أن الحاجز الأنفي قد ينثقب ويتقرح ببطء. وتتأثر الحنجرة والفم والحلق والحنك الرخو والوجه بهذه الآفة [ 32 ]. قد لا تُلحق العدوى البكتيرية ضررًا بالعظام، ولكن المرض غير المعالج قد يُسبب الإسهال والالتهاب الرئوي والسل [ 33 ]. يُعد الاختناق وأمراض الرئة والمجاعة من العوامل الأخرى التي قد تؤدي إلى الوفاة (نتيجة انسداد فتحة الحنجرة) [ 34 ].
5.3 داء الليشمانيات الجلدي التالي لداء الكالازار:
قد تظهر نوبة متكررة من داء الليشمانيا الحشوي، تُعرف باسم داء الليشمانيا الجلدي التالي لداء الليشمانيا الحشوي (PKDL)، على جلد الشخص بعد أشهر أو حتى 20 عامًا من تلقيه علاجًا جزئيًا، أو تركه دون علاج، أو حتى لدى أولئك الذين يُعتقد أنهم تلقوا علاجًا كافيًا [ 35 ، 36 ]. ويمكن إثبات هذه الحالة في ما يصل إلى 60% من الحالات التي تُعالج في السودان. وتظهر على شكل احمرار في الوجه أو آفات جلدية ناقصة التصبغ (مثل البقع والحطاطات والعقيدات). وعلى الرغم من أن داء الليشمانيا الجلدي التالي لداء الليشمانيا الحشوي يمكن أن يُسببه أي كائن حي يُسبب داء الليشمانيا الحشوي، إلا أنه غالبًا ما يرتبط بـالليشمانيا الدونوفانيةيُسبب هذا المرض أنماطًا مرضية متنوعة في السودان والهند. غالبًا ما تتقرح العُقيدات من النوع الأفريقي مع تقدم نموها، بينما تتوسع العُقيدات من النوع الهندي مع مرور الوقت وتُكوّن لويحات، ولكن نادرًا ما يحدث ذلك. يُعدّ تأثر الأعصاب أكثر شيوعًا في النوع الأفريقي منه في شبه القارة الهندية [ 37 ]. يُظهر الفحص النسيجي مجموعة متنوعة من الخلايا الالتهابية المزمنة؛ وقد توجد حبيبات بلعمية أو حبيبات ظهارية [ 38 ]. قد يعود التباين في تركيز الطفيليات بين الدراسات إلى استخدام تقنيات تشخيصية أقل حساسية في الدراسات السابقة.
6. السمات السريرية:
6.1 التقرح الجلدي:
قد تبقى العدوى الناتجة عن لدغة ذبابة الرمل بدون أعراض، أو قد تظهر على شكل حطاطة متقرحة متوسعة بعد فترة حضانة تتراوح بين أسبوع واحد و12 أسبوعًا. تشبه الخدوش أو الآفات العادية قرحة غير مؤلمة ذات حافة مرتفعة ومتصلبة وقاعدة نخرية غالبًا ما تكون مغطاة بقشرة ملتصقة من الإفرازات الجافة. يعاني معظم المرضى من آفة واحدة أو اثنتين، عادةً في المناطق المكشوفة، ويتراوح قطرها بين 0.5 و3 سم [ 39 ]. ومع ذلك، يوجد تباين كبير: فبينما تتطور بعض الآفات إلى التهاب الأوعية اللمفاوية العقدي الشبيه بداء سبوروتريكس، لا تتقرح آفات أخرى. قد ينتج الألم عن عدوى بكتيرية ثانوية نموذجية. وتترك ندوب ضمورية بعد شفاء معظم الآفات على مدى عدة أشهر إلى سنوات.L. tropicaتستغرق الآفات عادةً وقتًا أطول للشفاء – حوالي 10 أشهر – من تلك التي تسببهاL. majorأوL. mexicana، وL. brazilinesisتستمر الآفات عادةً لفترة أطول بكثير [ 40 ، 41 ]. وتنتج المقاومة الجزئية لإعادة العدوى عن الشفاء الطبيعي [ 42 ].
في دراسة شملت 475 حالة منL. majorفي المملكة العربية السعودية، وُجد الطفيلي في 50-80% من المسحات (بحسب الباحث والتقنية المستخدمة)، و70% من خزعات الجلد، و50% فقط من المزارع. وفي 10-20% من الحالات، حتى بعد الجمع بين الإجراءات الثلاثة، ظل الطفيلي غير قابل للكشف. وفي أمراض العالم الجديد، غالبًا ما تكون المشكلة أسوأ، لا سيما في الآفات التي يزيد عمرها عن ستة أشهر [ 43 ].
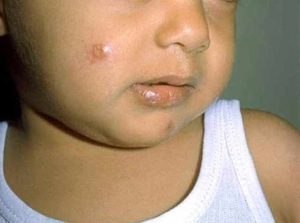
6.2 الطرق البديلة:
تشمل الطرق البديلة للحصول على عينات الأنسجة للتشخيص سحب العينات بالإبرة ومسحات الجلد المأخوذة من شق. يتم سحب العينة بالإبرة باستخدام محقنة ذات قفل لولبي سعة 2 مل، وإبرة قياس 20، و0.3 مل من محلول ملحي بتركيز 0.9%. تُدخل الإبرة عبر جلد سليم، ويُحقن 0.1 مل في حافة الآفة. تُسحب شظايا الأنسجة الصغيرة بعد فصلها عن حافة مسار الإبرة أثناء تدوير الإبرة ذهابًا وإيابًا مع الشفط. تُستخدم العينة المسحوبة لإعداد المسحات وزراعة العينات. أما مسحات الجلد المأخوذة من شق، فتُحضّر بقرص حافة الآفة بين الإبهام والأصابع، ثم عمل شق بعمق 1 مم باستخدام مشرط، ثم كشط الحافة المقطوعة [ 44 ].
نظرًا لأن الأجسام المضادة غالبًا ما لا تُكتشف أو تكون موجودة بكميات ضئيلة، فإن الاختبارات المصلية غير فعالة في علاج الأمراض الجلدية [ 45 ]. وعلى غرار اختبار التوبركولين، يكشف اختبار الليشمانين الجلدي عن المناعة الخلوية؛ إذ يصبح إيجابيًا بعد بدء تكوّن القشور على الخدوش، ويبقى كذلك. وهو غير قادر على التمييز بين العدوى الحالية والسابقة
7. أشكال الحبوب في اللايشمانيا الجلدية:
تُشير حطاطة تُشبه لدغة حشرة إلى بداية الآفة. تستمر هذه الحطاطة وتنمو تدريجيًا في الحجم بدلًا من أن تتراجع. تُعدّ الأشكال العقدية، والعقدية التقرحية، والتقرحية ثلاثة أشكال مورفولوجية شائعة في المرحلة التالية. يتميز الشكل التقرحي بقاعدة مسطحة ذات حواف مُلتوية، صغيرة كانت أم كبيرة. في حالة العدوى الثانوية، تتكون القاعدة من نسيج حبيبي وقد تكون مُغطاة بالصديد.
تُعدّ الحطاطات الثانوية، وهي حطاطات صغيرة (2-4 مم) على طول محيط الآفة، جانبًا مهمًا آخر من جوانب الشكل. ويظهر اتجاه ثنية الجلد في الآفات. غالبًا ما تتجمع الآفات المتعددة معًا؛ إذ تلدغ ذبابة الرمل نفس البقعة مرارًا وتكرارًا، ناقلةً الطفيليات مع كل لدغة.
السمات السريرية الخاصة بـL. majorالعدوى هي: [ 47 ].
-
سماكة منتشرة بدون تقرح (شكل يشبه الحمرة).
-
التهاب الشفة الليشماني.
-
قرحة تشيكليرو؛ وهي قرحة تصيب صيوان الأذن.
-
آفات تشبه الورم الفطري.
-
التهاب الأصابع الليشماني.
-
داء الليشمانيات الجلدي في الأنف.
-
داء الليشمانيات الجلدي الشبيه بداء سبوروتريكس: ينتشر المرض على طول الأوعية اللمفاوية كما هو الحال في داء سبوروتريكس.
داء الليشمانيات المتكرر، المعروف أيضًا باسم داء الليشمانيات الذئبي، هو شكل سريري فريد من نوعهL. tropicaالعدوى؛ في هذه الحالة، يبدو أن القرحة تلتئم لكنها تعود للظهور على طول حافة الآفة، وهي عملية قد تستمر لسنوات عديدة وقد تُسبب تشوهًا. ومثل السل الجلدي، فإنها (الذئبة الشائعة). عادةً، يكون عدد الطفيليات قليلًا، ويكون اختبار حساسية الجلد إيجابيًا للغاية.
8. العدوى في الحيوانات:
8.1 العلامات السريرية
8.1.1 الكلاب :
تُعد الكلاب البرية والكلاب المنزلية الخزانات الرئيسية لداء الليشمانيات الحشوي الحيواني المنشأ الذي يسببهالليشمانيا الرضيعيةفي منطقة البحر الأبيض المتوسط والشرق الأوسط والدول الآسيوية وأمريكا اللاتينية. ونظرًا لأن الكلاب تُعدّ الخزان الرئيسي لداء الليشمانيات الحشوي، فقد زاد ذلك من أهمية البحث في الاستجابة المناعية والبحث عن مستضدات الليشمانيا المرتبطة بالمناعة الخلوية الوقائية في داء الليشمانيات الحشوي لدى الكلاب. وقد ألقت الدراسات الحديثة ضوءًا جديدًا على الأسس الجينية والفيزيولوجيا المرضية وعلم المناعة وعلم الأوبئة لداء الليشمانيات لدى الكلاب. وقد ساهمت هذه الاكتشافات الجديدة في تحسين فهمنا للمرض، وساعدت في ابتكار تقنيات تشخيصية جديدة واستراتيجيات لمكافحة العدوى، مثل أطواق الكلاب المشبعة بالمبيدات الحشرية، والأدوية الجديدة، ولقاحات الجيل الثاني [ 48 ، 49 ].
قد تبقى بعض الكلاب المصابة بدون أعراض أو تظهر عليها أعراض طفيفة، وهو ما يُعرف بالعدوى قليلة الأعراض [ 50 ]. وقد تعاني بعض الكلاب المصابة من أعراض تؤدي إلى الوفاة. وتتمثل السمة النسيجية المميزة في الجلد والكبد والطحال في استجابة التهابية حبيبية مرتبطة بأشكال الليشمانيا اللا سوطية داخل البلاعم [ 51 ].
تم استخدام المؤشرات السريرية لداء الليشمانيات الحشوي الكلبي لتصنيف مجموعة من الكلاب المختلطة السلالات المصابة بعدوى الليشمانيا التلقائية على أنها مصحوبة بأعراض أو بدون أعراض [ 52 ].
لوحظ أن الكلاب المنزلية في أمريكا اللاتينية تنقبض بشكل طبيعيL. braziliensis، L. peruviana، L. panamensis، Leptodactylus colombiensis، و L. mexicana[ 48 ]. لا يوجد حاليًا دليل قاطع على أن الكلاب تُعدّ مضيفًا خازنًا لانتشار داء الليشمانيا الجلدي داخل المنازل [ 53 ، 54 ]. تركز غالبية الأبحاث على تحديد مدى انتشار داء الليشمانيا الجلدي في الكلاب، ولكن لا يُعرف إلا القليل عن الجوانب الطفيلية والمناعية للعدوى.
8.1.2 القطط:
يمكن أن تُصاب القطط بداء الليشمانيات، ولكن يُعتقد أن معظم القطط المصابة لا تظهر عليها أعراض. غالبًا ما تُوصف آفات جلدية أو مخاطية، مصحوبة أو غير مصحوبة بأعراض حشوية. مع ذلك، قد تظهر الأعراض الحشوية دون إصابة جلدية. يمكن أن تظهر الآفات الجلدية في أي مكان على جسم القطة، ولكنها تظهر في أغلب الأحيان على الشفاه والأنف والأذنين والجفون والكفوف. أكثر الآفات شيوعًا هي الحطاطات والعقيدات الموضعية، والآفات المزمنة المتقشرة أو المتقرحة؛ وقد يُلاحظ أيضًا تضخم في الغدد الليمفاوية المجاورة. سُجلت حالات نادرة من تساقط الشعر، والقشور، والبثور أو العقيدات النزفية. غالبًا ما تكون الآفات الأولية مفردة، على الرغم من أنها قد تكون متعددة في بعض الأحيان، وقد تنتشر أحيانًا.
وردت تقارير عن إصابة الأغشية المخاطية الفموية والأنفية، وفي بعض الحالات الأغشية المخاطية الأخرى (مثل الغشاء المخاطي الشرجي). قد تظهر على بعض القطط أعراض عينية، بما في ذلك التهاب العنبية أحادي الجانب أو ثنائي الجانب، والتهاب الملتحمة، والتهاب الجفن (الذي قد يتطور إلى التهاب شامل للعين). وتُعدّ الحمى، وتضخم الكبد، واليرقان، والقيء، والإسهال، وتضخم الغدد الليمفاوية، وضيق التنفس، والإفرازات الأنفية، وفقر الدم، وقلة الكريات البيضاء، مجرد أمثلة قليلة على التشوهات والأعراض الحشوية التي لوحظت لدى القطط [ 55 ].
8.1.3 الخيليات:
قد تظهر آفات جلدية أحيانًا على الخيول والبغال والحمير، وخاصةً في الرأس والرقبة والأرجل ومنطقة الفخذ أو الإبط. وتُعدّ الحطاطات أو العُقيدات، سواءً كانت منفردة أو متعددة، والتي غالبًا ما تكون مصحوبة بتقرحات، أكثر الآفات شيوعًا. بالإضافة إلى ذلك، تم توثيق حالات انتشار أمراض جلدية واسعة النطاق. وعلى الرغم من عدم توثيق داء الليشمانيات الحشوي في الخيول، إلا أن الطفيليات وL. braziliensisتم العثور على الأحماض النووية في دم ونخاع عظام حيوانات أخرى في أمريكا الجنوبية [ 55 ].
8.2 الحيوانات الأليفة الأخرى:
نادرًا ما تم الإبلاغ عن حالات طبية في الأبقار أو المجترات الصغيرة الأخرى. ولوحظت فقط آفات جلدية، مصحوبة أحيانًا بتضخم الغدد الليمفاوية، في الماعز والأغنام والأبقار. في ألمانيا، تم الإبلاغ عن بقرة حامل مصابة بـليتشيتيا مارتينيوكينسيسظهرت على الأغنام المصابة بالعدوى عدة آفات جلدية تقرحية أو تشبه اللويحات في أجزاء مختلفة من الجسم. وبعد الولادة، تعافت تمامًا. وكان العرض السريري الوحيد لدى الأغنام المصابة تجريبيًا هو الحمى. أما الخنازير المصابة تجريبيًا فلم تظهر عليها أي أعراض.
نادرًا،L. enriettiiلوحظت آفات جلدية، غالباً على الأذن، لدى خنازير غينيا المصابة بشكل طبيعي. تبدأ الآفات الأولى لدى الحيوانات المصابة تجريبياً باحمرار وتورم، لكنها سرعان ما تتطور إلى كتل متقرحة كبيرة تشبه الأورام. في حين كشفت بعض الدراسات عن آفات ثانوية في مواقع أخرى، بما في ذلك الجلد والشفة والأعضاء التناسلية، زعمت دراسات أخرى أن الآفات لم تنتشر. بالإضافة إلى ذلك، وُجدت الطفيليات في أعضاء داخلية مختلفة. وقد وُثِّق الشفاء التلقائي في بعض الدراسات دون غيرها. تكوّنت لدى الهامستر عُقيدات غير متقرحة اختفت من تلقاء نفسها بعد الإصابة.L. enriettiiالعدوى في تجربة.
8.3 الأنواع البرية والحيوانات البرية الأسيرة:
تشابهت الحالات القليلة المعروفة لداء الليشمانيات في الكلبيات البرية أو الأسيرة مع داء الليشمانيات في الكلاب. وقد وُجد أن بعض الرئيسيات غير البشرية تعاني من إصابة حشوية مصحوبة بأعراض غير محددة (مثل شحوب الأغشية المخاطية وفقدان الوزن). كما ظهرت على أسد أعراض سريرية لالتهاب القولون، بما في ذلك الإسهال الدموي، ونزيف الأنف، وفقدان الوزن، وتقرحات في باطن القدم.
L. martiniquensisأظهرت الجرابيات الأسترالية المصابة في الأسر آفات جلدية تشمل عقيدات شاحبة مرتفعة ومتقشرة أو متقرحة، بالإضافة إلى بقع متقاربة من الجلد السميك. بعض الفئران المصابة بـL. mexicanaأُبلغ عن وجود آفات جلدية لدى بعض أنواع الحيوانات في بيئتها الطبيعية. توصف هذه الآفات بأنها قرح أو نتوءات متورمة مصحوبة بتساقط الشعر. وذُكر أن قاعدة الذيل هي أكثر الأماكن ظهورًا لها، ولكنها قد تظهر أيضًا على الأذنين أو أصابع القدم. ومن المعروف أن العديد من الأنواع مصابة بعدوى تحت الإكلينيكية [
9. علاج حبة حلب:
لحسن الحظ، توجد بعض القواعد التي يجب اتباعها. قد يكون اتباع استراتيجية الانتظار والمراقبة للشفاء التلقائي مقبولاً، لأن معظم الآفات تلتئم بسرعة دون علاج، خاصةً للمرضى الذين يعيشون في المناطق الموبوءة، حيث يرتبط الشفاء التلقائي بتطور المناعة الوقائية. يُنصح بمعالجة الآفات المتعددة أو المستمرة، أو المصحوبة بالتهاب الأوعية اللمفاوية، أو الموجودة في أماكن ذات أهمية تجميلية أو وظيفية كاليدين أو الوجه، أو التي تحتوي على عدة آفات. يجب أن يتلقى المرضى الذين يعانون من آفات مبكرة غير ملتهبة علاجًا موضعيًا؛ أما المرضى الذين يعانون من آفات كثيرة أو آفات أكثر تعقيدًا، فيجب أن يتلقوا علاجًا جهازيًا.
9.1 ستيبوغلوكونات الصوديوم وميغلومين أنتيمونات:
يمكن علاج مرضى داء الليشمانيات الجلدي بحقن موضعي داخل الآفة بجرعة تتراوح بين 1 و5 مل (100 ملغ/مل) من ستيبوغلوكونات الصوديوم (SSG) يومًا بعد يوم لمدة ثلاثة أيام مرة واحدة شهريًا، وفي معظم الحالات، يؤدي ذلك إلى الشفاء التام بنهاية الشهر الثاني [ 56 ]. أما في حالة الآفات المتعددة والكبيرة، فقد تطلب الأمر جرعة أعلى وأكثر من ثلاث دورات علاجية. بالإضافة إلى الحقن الموضعي لستيبوغلوكونات الصوديوم في بعض الآفات، استخدم شارما وزملاؤه الحقن العضلي لستيبوغلوكونات الصوديوم (800 ملغ/يوم) [ 56 ]. يُعد ميغلومين أنتيمونات دواءً بديلًا، وهو الدواء المفضل في الإكوادور [ 57 ]. في نيبال، يُعطى غلوكونات أنتيمون الصوديوم (20 ملغ/كغ/يوم) عن طريق الحقن العضلي لمرضى داء الليشمانيات الجلدي التالي للكلامي لمدة تتراوح بين 30 و72 يومًا [ 58 ].
تُعدّ مقاومة الأدوية مشكلة، وقد سُجّلت حالات داء الليشمانيات الحشوي المقاوم لستيبوغلوكونات الصوديوم في نيبال [ 59 ، 60 ]. وحتى الآن، لم تُسجّل هذه المشكلة في نيبال فيما يخص داء الليشمانيات الجلدي. ولا يزال العلاج الأكثر فعالية لداء الليشمانيات الجلدي والمخاطي الجلدي الأمريكي (ACML) غير معروف. منذ أربعينيات القرن الماضي، استُخدمت أدوية الأنتيمون الخماسية التكافؤ، مثل ستيبوغلوكونات الصوديوم (SSG) وميغلومين أنتيمونات (غلوكانتيم، ماساتشوستس)، إلا أنها باهظة الثمن وسامة وغير مريحة [ 61 ]. يُنصح بتحديد نوع الليشمانيا بدقة قبل بدء العلاج، لأن الأدوية الفعالة لنوع معين من الليشمانيا قد لا تكون فعالة لنوع آخر. للأسف، يُعدّ داء الليشمانيات مرضًا نادرًا في الدول الغنية، ومعظم العلاجات المتاحة سامة ولها آثار جانبية خطيرة [ 61 ].
بالمقارنة مع العلاج بالحقن، ينتج عن هذا تركيزات موضعية أعلى وآثار جانبية جهازية أقل. يتم إجراء حقن الأنتيمون (1-5 مل) مرتين إلى ثلاث مرات أسبوعيًا. تأكد من أن الحقنة في موضع الآفة وليس في الأنسجة تحت الجلد. قد يكون الأمر مؤلمًا للغاية. هناك أدلة متزايدة على فائدته في علاجL. tropicaالعدوى، بالإضافة إلى داء الليشمانيات الجلدي الناجم عنL. major[ 62 ].
10. العلاجات الفيزيائية لحبة حلب:
تلقى المرضى من جميع الأعمار علاجًا لداء الليشمانيات الجلدي باستخدام مجموعة متنوعة من التقنيات الفيزيائية، مثل الاستئصال الجراحي والكي والعلاج بالتبريد واستخدام الحرارة الموضعية.
10.1 العلاج بالتبريد:
تتضمن المعالجة بالتبريد تطبيق النيتروجين السائل بشكل متكرر على الآفة حتى مسافة 2 مم خارج حدودها باستخدام أداة تطبيق ذات طرف قطني أو مسحة قطنية بضغط معتدل. مدة التجميد لكل تطبيق تتراوح بين 15 و20 ثانية. تُكرر العملية مرتين أو ثلاث مرات مع فترات راحة قصيرة، وتستغرق ما بين 30 و120 ثانية إجمالاً. يشير تبييض الجلد على بعد 2-3 مم من حواف الآفة إلى نجاح العلاج [ 63 ، 64 ، 65 ، 66 ]. تشمل الأعراض النموذجية بعد التجميد ظهور بثور على الآفة لمدة يومين إلى ثلاثة أيام، وتكوّن قشور، ووذمة خفيفة، وتكوّن جلبة [ 63 ، 64 ، 65 ، 66 ].
11. العلاج في الحيوانات:
نادرًا ما تتلقى الحيوانات علاجات موضعية، لكن العلاج الحراري باستخدام الترددات الراديوية كان فعالًا في علاج كلبين مصابين بعدة آفات جلدية مخاطية موضعية على الخطم. في بعض الحيوانات، مثل بعض القطط وبعض الخيول، لم تعاود الآفات الجلدية الظهور بعد الاستئصال الجراحي؛ ولكن في حالات أخرى، لم يكن الاستئصال الجراحي وحده فعالًا.
11.1 التحكم في الناقل:
نظريًا، يمكن السيطرة على العدوى بمنع انتقالها عن طريق ذبابة الرمل الناقلة. وتبعًا لنوعها، تتغذى بعض ذبابات الرمل داخل المنازل، بينما تتغذى أنواع أخرى خارجها. تشمل أساليب المكافحة استخدام مواد طاردة، لا سيما البيرثرويدات، ومبيدات حشرية مثل DDT. في أغلب الأحيان، لا تزال ذبابات الرمل حساسة للمبيدات الحشرية، على الرغم من التقارير التي تشير إلى مقاومتها لـ DDT. وقد أثبت الرش فعاليته على المستوى المحلي، لكن من غير الواضح تأثير الرش الشامل على أعداد ذبابات الرمل، كما أن الحفاظ على هذه البرامج يمثل تحديًا. توفر الناموسيات حماية ضد الأنواع التي تتغذى على الكائنات الحية [ 67 ]، حيث توفر الناموسيات المشبعة بالبيرثرويدات حماية إضافية، مما يقلل معدلات اللدغ بنسبة تصل إلى 64-100% [ 68 ]. يعتمد نجاح الناموسيات كطريقة مكافحة طويلة الأمد على الصيانة الدورية، واستبدال الناموسيات التالفة، وإعادة تشريبها، ونشرها في المناطق الريفية. إن قدرة الناموسيات على وقف انتشار الملاريا إلى الأطفال قد زادت من الحافز لتحسين هذه الطريقة في مكافحة الملاريا، بما في ذلك البحث في الناموسيات المعالجة بمبيدات حشرية طويلة الأمد [ 68 ].
11.2 خزانات الحيوانات:
داء الليشمانيات مرض حيواني المنشأ منتشر في جميع أنحاء العالم، مع وجود خزانات عدوى كبيرة في الحيوانات البرية والمستأنسة. وقد استُهدفت الكلاب في حوض البحر الأبيض المتوسط والبرازيل. أثبت استخدام أطواق الكلاب المشبعة بمادة دلتا مثرين أنه أنجح الأساليب، حيث يوفر للكلاب حماية تصل إلى 86% خلال مواسم انتقال العدوى [ 69 ]. كما استُخدم قتل الكلاب، وتشير نماذج من دراسة برازيلية إلى أنه في المناطق ذات التوطن المنخفض، يُفترض أن يكون لكل من قتل الكلاب واستخدام أطواقها تأثير نسبي أكبر. ومع ذلك، مع ارتفاع معدلات انتقال العدوى، تتضاءل الفائدة النسبية لأطواق الكلاب [ 70 ]. وقد تضاءلت فعالية برامج مكافحة النواقل وخزانات الحيوانات بسبب انخفاض استخدام المبيدات الحشرية وارتفاع معدل الانتشار بين سكان المدن. ونظرًا لتنوع الأوضاع الوبائية، وتعدد العوامل المؤثرة على انتقال المرض، والفهم المستمر لبيولوجيا الطفيل وناقله وخزاناته، فقد ثبت أن إدارة المرض أمر بالغ الصعوبة. ولتجنب هذه المشاكل، يُعد اللقاح المخصص للبشر أو الكلاب خيارًا مفضلًا.
11.3 اللقاحات:
يُمكن إيجاد أساس منطقي لتطوير اللقاحات في اكتشاف أن المناعة القوية ضد إعادة العدوى تُصاحب الشفاء التلقائي أو المُستحث بالأدوية من داء الليشمانيا الجلدي أو داء الليشمانيا الحشوي. وقد أدى هذا الاكتشاف إلى ظهور تقنية “التطعيم ضد الليشمانيا” القديمة، وهي استخدام طفيليات حية مُستخرجة من آفات جلدية لإحداث آفات في مناطق مُحددة من الجسم بهدف منع المرض عند إعادة العدوى. وقد مُورست هذه العادة لما لا يقل عن 2000 عام. بين عامي 1982 و1986، تلقى حوالي 1.2 مليون مريض في إيران هذا التطعيم الحي [ 71 ]. أظهر 93% من الأشخاص الذين ظهرت لديهم آفات جلدية بعد تلقي التطعيم نتيجة إيجابية لاختبار فرط الحساسية المتأخر لليشمانيا، وهو مؤشر ميداني جيد على مناعة السكان. وظهرت آفات جلدية لدى ما يقرب من 50% من متلقي التطعيم. بالإضافة إلى ذلك، لوحظ انخفاض ملحوظ في معدل الإصابة بالمرض، من 14% في المجموعة التي لم تتلقَّ التطعيم إلى 2.5% في المجموعة التي تلقته. ورغم أن استخدام الكائنات الحية غير المتجانسة ذات الضراوة المنخفضة كلقاحات ضد أنواع أكثر ضراوة لم يُؤدِّ دائمًا إلى حماية شاملة بين الأنواع، إلا أنه مُبرَّرٌ بزيادة التفاعل المناعي المتبادل بين الأنواع على المستويين الخلطي والخلوي. لم يعد يُستخدم التطعيم ضد الليشمانيا بسبب خطر الإصابة الموضعية بالمرض وانتشار فيروس نقص المناعة البشرية، فضلًا عن استحالة إيصال مزارع جديدة من اللقاح الحي في الميدان. يُتيح استخدام الكائنات الحية المُضعَّفة التعرضَ لمجموعة أوسع بكثير من المستضدات مقارنةً باللقاحات الفرعية الأكثر تعقيدًا، مما يُؤدي إلى استجابة مناعية تُحاكي إلى حد كبير الاستجابة المناعية للعدوى الطبيعية. مع ذلك، حتى عند استخدام الكائنات الممرضة الطبيعية لعلاج داء الليشمانيات لدى البشر أو الفئران في التجارب [ 72 ]، أو الكائنات المعرضة للعدوى [ 73 ]، أو الكائنات المعدلة وراثيًا [ 74 ]، لم يُحقق سوى نجاح ضئيل. وبالمثل، تتميز اللقاحات غير الفعالة بانخفاض قدرتها على إثارة الاستجابة المناعية وفعاليتها حتى عند إضافة مواد مساعدة، مثل عصية كالميت غيران (BCG) أو الشب [ 75 ]. ومن المثير للاهتمام أن لقاح BCG وحده تسبب في نتيجة إيجابية لاختبار الليشمانين الجلدي لدى بعض الأشخاص، على الأرجح بسبب التفاعل المتبادل بين المتفطرات والليشمانيا. في حين أن فعالية الجرعة الواحدةL. majorبلغت نسبة نجاح التطعيم المدمج مع لقاح BCG في الكلاب حوالي 70% [ 76 ]. وقد أظهر هذا النهج نتائج واعدة كسياسة تطعيم محتملة ضد مرض طبيعيالليشمانيا الرضيعيةعدوى تُعطى للكلاب، مستضدات إفرازية طبيعية مستخلصة من سائل مزرعةالليشمانيا الرضيعيةالطور السوطي [ 77 ]. تُعدّ TSA وLeIF وLmSTI1 ثلاثة مستضدات ليشمانية مُعاد تركيبها أظهرت قدرة على تحفيز الاستجابة المناعية في الكلاب [ 78 ]. تُبشّر التطورات الحديثة في ابتكار لقاح يمنع انتقال العدوى بالأمل، نظرًا لأهمية الكلاب كمستودعات للفيروس. وقد حقق اللقاح حماية بنسبة 92-97% ضد داء الليشمانيات الحشوي الحيواني المنشأ.لابروس دونوفانيأظهر مستضد رابطة الفوكوز-مانوز (FML) مع الصابونين (لقاح FML و Leishmune) حمايةً ملحوظةً استمرت حتى 12 شهرًا [ 79 ]. ويُعدّ البحث في استخدام مركبات محددة كلقاحات بشرية استراتيجيةً بديلة. وقد نجحت النماذج الحيوانية للقاح ببتيد gp63 [ 80 ]. ومع ذلك، فإنّ عدم القدرة على تحفيز المناعة الخلوية بشكل كافٍ، وهو عنصر ضروري للسيطرة على العدوى داخل الخلايا، قد ساهم في ضعف فعالية هذه اللقاحات عمومًا لدى البشر.
11.4 لقاحات الحمض النووي:
لقد وفر ابتكار لقاحات الحمض النووي حلاً مبتكرًا لهذه المشكلة. فبحسب وولف وآخرون، يمكن أن يؤدي الحقن العضلي للحمض النووي البلازميدي الذي يُعبِّر عن مجموعة متنوعة من الجينات المُبلِّغة إلى تحفيز خلايا العضلات على إنتاج البروتينات [ 81 ]. تُوفِّر هذه الدراسة أساسًا متينًا لمفهوم إمكانية إيصال الأحماض النووية المُعاد تركيبها النقية داخل الجسم الحي لتنظيم إنتاج البروتين. وقد وجدت دراسات لاحقة أن لقاحات الحمض النووي قادرة على حماية الفئران من داء الليشمانيات الجلدي [ 82 ]. تُعد القدرة على الاحتفاظ بالمعلومات على المدى الطويل أحد المحددات الرئيسية لفعالية اللقاح. يُعد الحمض النووي الذي يُشفِّر مستضد الليشمانيا LACK أفضل من التطعيم ببروتين الليشمانيا وبروتين IL-12 للحفاظ على استجابات الخلايا التائية المساعدة من النوع الأول (Th1) النوعية للمستضد، والتي يمكن أن تُقيِّدL. majorالعدوى [ 83 ]. يُعد استمرار المستضد وتفعيل إنترلوكين-12 بواسطة أنماط CpG عاملين يفسران سبب كون التطعيم بالحمض النووي أكثر فعالية من التطعيم بالبروتين والمواد المساعدة. في تجربة على داء الليشمانيات، أظهرت دراسة أن الأجسام المضادة لمستقبل إنترلوكين-10 أدت إلى الشفاء التام، ولكن فقدان المناعة ضد إعادة العدوى، مما يدل على أن استمرار الطفيلي ضروري للحفاظ على المناعة [ 84 ]. ومع ذلك، يمكن للقاحات الحمض النووي أن تحفز مناعة طويلة الأمد في غياب مستضد ملحوظ. ويتم ذلك إما عن طريق السماح ببقاء مستضد غير قابل للكشف، ربما في الخلايا المتغصنة الجريبية، أو عن طريق تحفيز استجابات مناعية مستقلة عن المستضد [ 85 ]. ووفقًا للدراسات، فإن خلايا الذاكرة التائية متنوعة، حيث يهاجر جزء منها (خلايا الذاكرة التائية المركزية) عبر العقد اللمفاوية، بينما يهاجر جزء آخر إلى الأنسجة وينتج السيتوكينات المؤثرة [ 86 ]. وتشير الأبحاث الحديثة إلى أنه حتى في غياب الطفيليات، يمكن لخلايا الذاكرة التائية المركزية أن تتوسط الذاكرة طويلة الأمد [ 87 ]. لذا، يُعدّ تحديد المسارات التي تُحفّز خلايا الذاكرة التائية المركزية تحديًا كبيرًا للقاحات الحمض النووي. وقد دُرست إمكانية تحسين فعالية لقاحات الحمض النووي المناعية بعدة طرق. فمن خلال عملها كروابط لمستقبلات تول لايك (TLR)، تُطلق مواد مساعدة جديدة، بما في ذلك زخارف CpG ودهون أحادية الفوسفات A، إنترلوكين-12 (IL-12) وتحفز استجابة الخلايا التائية المساعدة من النوع الأول (Th1). كما استُخدم التحصين الأولي المعزز غير المتجانس كطريقة أخرى لتحسين استجابة الإنسان للتطعيم. وقد دُرست تركيبات مختلفة، لكن التحصين الأولي باستخدام الحمض النووي والتحصين المعزز باستخدام MVA حظيا بأكبر قدر من الاهتمام [ 88 ]. تُظهر هذه الدراسة أن إنترلوكين-10 (IL-10) يلعب دورًا حاسمًا في الاستجابة المناعية، وذلك من خلال إظهار أن فعالية اللقاح ضد هذه المستضدات في نموذج BALB/c كانت مُحددة بواسطة إنترلوكين-10 (IL-10) المُفرز من الخلايا التائية التنظيمية. الجين الأكثر شيوعًا بين علامات التسلسل المُعبر عنها من مكتبات الحمض النووي المكمل (cDNA) هوL. majorأظهرت دراسات مبكرة [ 89 ] أن TryP كان مستضدًا وقائيًا قابلًا للتكرار ضد العدوى في فئران BALB/c المعرضة للإصابة. LACK،L. majorيُعد البروتين 1 المُحفَّز بالإجهاد، وعامل استطالة الليشمانيا، وHASPB1، وهو بروتين سطحي مُؤَسْتَل مُحِب للماء خاص بمرحلة معينة في الفئران، من المستضدات الأخرى الفعالة في الفئران والرئيسيات غير البشرية. وذلك من أجل التحصين ضد الليشمانيا الموجودة في اللعاب.L. majorفي إطار التحديات، تم أيضًا دراسة استخدام مستضدات اللعاب في الحمض النووي البلازميدي [ 90 ]. وقد تم اكتشاف 8500 جين حتى الآن.L. majorيُعد تسلسل جينوم فريدلين الكامل مصدرًا لمرشحين محتملين للقاح [ 91 ]. لا يُشترط أن يكون المستضد المستهدف جزيئًا سطحيًا لأن الطفيلي موجود في الداخل، مما يُوسع بشكل كبير نطاق المرشحين المحتملين للقاح. وقد أُجري فحص شامل للقاح على 100 جين مختلف من جينات الليشمانيا المُعبر عنها في الأمستيجوت، وذلك باستخدام نموذج فأر BALB/c مُصاب بالطفيلي.L. majorتم استخدام التطعيم بالحمض النووي ضد السلالة الفرعية LV39 [ 90 ]. وقد نجحت استراتيجية التحصين الأولي والتعزيزي غير المتجانسة ضد داء الليشمانيات الحشوي التجريبي في الكلاب باستخدام الحمض النووي/بروتيازات السيستين المؤتلفة من النوع الأول والثاني [ 92 ]. ونحن نتطلع بشغف إلى نتائج تجارب إضافية على الكلاب، بالإضافة إلى دراسة بشرية حول التطعيم بالحمض النووي.
المصدر: intechopen.com – آخر تحديث: 09/02/2026